Лаборатория генной инженерии растений

|
Заведующий лабораторией: доктор биологических наук Долгов Сергей Владимирович тел. (499) 977 95 13; e-mail: dolgov@fibkh.serpukhov.su |
Сотрудники:
Сотрудники:Окунева Анна Сергеевна — н.с.
Митрофанова Ирина Вячеславовна — в.н.с., д.б.н.
Шульга Ольга Альбертовна — в.н.с., к.х.н.,
Мирошниченко Дмитрий Николаевич — с.н.с., к.б.н.,
Митюшкина Татьяна Юрьевна — с.н.с., к.б.н.,
Фирсов Алексей Петрович — в.н.с., к.б.н.
Пушин Александр Сергеевич — м.н.с.
Тимербаев Вадим Рафаилович — м.н.с.
Кудрявцев Всеволод Анатольевич - инженер
Основное направление исследований
Получение трансгенных растений, обладающих хозяйственно-ценными признаками.
Научно-исследовательская работа ведется в рамках программ НИР отделения растениеводства Россельхозакадемии 04.03.03.01, Минобрнауки РФ «Живые системы» и поддерживается грантами Минобрнауки (Контракт № 02.452.12.7103) и МСХ РФ
- ГК № 420/26 «Проведение исследований и получение трансгенных растений сельскохозяйственных культур (томатов, яблони) с редуцированным уровнем эндогенного этилена с целью увеличения продолжительности хранения плодов»,
- ГК № 188/13 «Проведение исследований и получение трансгенных растений пшеницы и ячменя, устойчивых к абиотическим стрессам»,
- ГК № 1282/13 «Получение высокопродуктивных линий рапса, устойчивых к основным видам болезней и вредителей биотехнологическими методами, с проведением полевых испытаний»,
- ГК № 1271/13 «Получение клоновых подвоев семечковых культур, устойчивых к гербицидам сплошного действия».
Основные объекты разработок: томаты, рапс, ячмень, рясковые.
Томат
- Изучение регенерационной и трансформационной способностей отечественных сортов и селекционных линий томата;
- Генетическая трансформация томата с целью повышения устойчивости к стрессовым факторам биотической и абиотической природы.
В результате серии экспериментов по генетической трансформации были получены трансгенные растения томата селекционной линии ЯЛФ, несущие гены защитных антимикробных пептидов из сорного растения Stellaria media, хитин-связывающих белков из растений рода Amaranthus (A. caudatus и A. Retraflexus), а также тауматинподобных белков из Thaumatococcus danielii.
В настоящее время проводится:
- изучение экспрессии генов хитин-связывающих белков и антимикробных пептидов;
- анализ расщепления полученного потомства Т1;
- проведение лабораторных и тепличных испытаний растений, экспрессирующих гены хитин-связывающих белков и антимикробных пептидов, на устойчивость к бактериальным и грибным фитопатогенам;
- оценка устойчивости трансгенных растений томата Т2 к основным фитопатогенам в лабораторных условиях и в условиях защищенного и открытого грунта.

|
Рис. 1 Трансгенные растения T0 в культуре in vitro. |
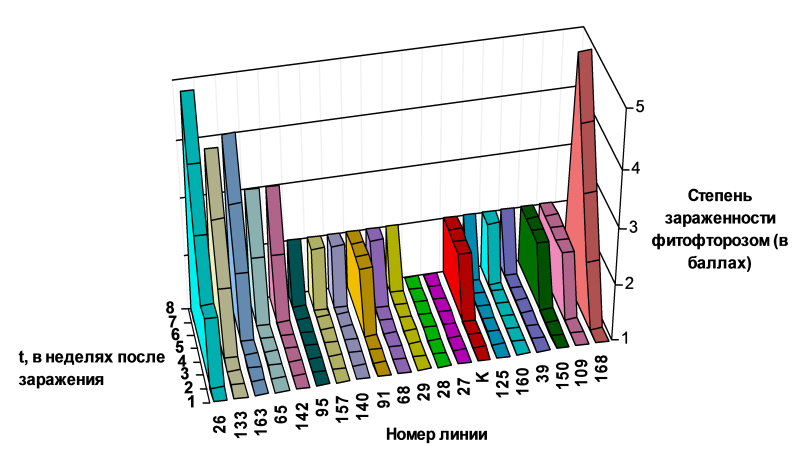
Рис. 2. Оценка полевой устойчивости трансгенных растений томата Т0 к фитофторе Phytophthora infestans в условиях защищенного грунта , где степень зараженности (в баллах) трансгенных растений томата фитофторой (1 балл - 0 % , 2- 25 %, 3- 50 %, 4-75 %, 5-100 %). К –контроль, слева от контроля трансгенные растения с генами nptII и ThauII, справа - с геном nptII.

Рис. 4. Оценка устойчивости трансгенных растений томата Т2, несущего ген ThauII, к бактериальной черной пятнистости Xanthomonas vesicatoria в условиях защищенного грунта (некрозы на листьях контрольного и трансгенных растений томата с различной степенью устойчивости к болезни).
Рапс
Получение высокопродуктивных линий рапса с генами устойчивости к биотическим и абиотическим факторам. Трансформацию отечественных «00» сортов ярового (Аккорд, Визит, Луговской, Мадригал, Ратник, Форум) и озимого (Северянин) рапса проводили с использованием генетических конструкций, несущих гены патоген-индуцируемых защитных белков семейства PR5, антимикробных пептидов и устойчивости к гербициду сплошного действия.
В настоящее время в результате научно-исследовательской работы достигнуты следующие результаты:
- разработан способ эффективного соматического органогенеза рапса;
- проведена генетическая трансформация ярового и озимого рапса;
- получены гербицидоустойчивые линии ярового рапса сортов Визит (1), Ратник (4), Мадригал (1) и озимого рапса сорта Северянин (7);
- получено 5 линий озимого рапса сорта Северянин, несущих ген kiwiTLP, из них 2 линии с экспрессией данного гена.
Полученные растения рапса, активно синтезирующие новые пептиды и белки, приобретут устойчивость к грибковым заболеваниям и гербицидам, что позволит сократить количество агротехнических приемов и снизить себестоимость продукции.
3 недели после обработки 0.75% раствором «Либерти» (слева нетрансгенный контроль Справа трансгенные линии)

Биофарминг
Одним из приоритетных направлений развития биотехнологии является создание трансгенных растений, экспрессирующих различные целевые гены, и использование их в качестве биофабрик по производству белков («биофарминг»). Преимуществом использования растительных систем являются отсутствие общих с человеком и животными патогенов, культивирование на достаточно простых искусственных средах, высокий уровень экспрессии гетерологичных белков. Большая прогрессия размножения при малых размерах и высокое содержание белков в сухой массе позволяют культивирование растений семейства Lemnaceae как продуцентов целевых белков в биореакторе.
В лаборатории проводятся исследования, направленные на разработку технологии глубинного культивирования в гидродинамическом биореакторе вольфии бескорневой и системы эффективной генетической трансформации растений семейства Lemnaceae с использованием биобаллистики.
Рис. 4. Глубинное культивирование Wolffia arrhiza в биоректоре «Biostat PBR 2S» («Sartorius», Germany).
Система биолистической трансформации является одной из самых распространенных наряду с агробактериальной. Биолистический способ относится к прямым методам и может быть использован для проведения трансформации широкого круга растений (как однодольных, так и двудольных). Изучение наличия событий трансформации, а также отбор трансгенных клеток и тканей проводится с использованием репортерного гена gfp. Основным преимуществом данной репортерной системы является то, что свечение от GFP можно регистрировать в реальном времени при помощи флюоресцентного микроскопа; ткани экспланта при этом не повреждаются и могут быть использованы в дальнейших экспериментах.
С помощью имеющейся в лаборатории генной пушки PDS-1000/He (PDS-Particle Delivery System) и флуоресцентного микроскопа Leica MZ FLIII (Leica Microsystems, Wetzlar, Germany), укомплектованного фильтрами GFP, были получены трансгенные растения ячменя, устойчивые к гербициду.
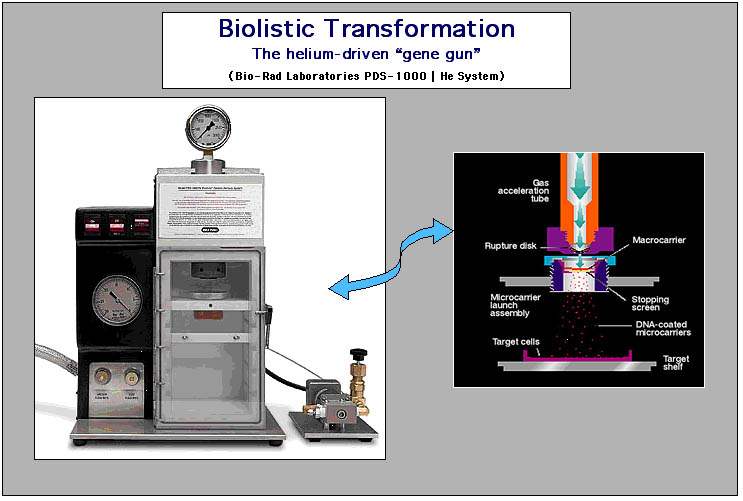
Рис. 5. Генная пушка PDS-1000/He (Bio-Rad) и флуоресцентный микроскоп Leica MZ FLIII (Leica Microsystems, Wetzlar, Germany).
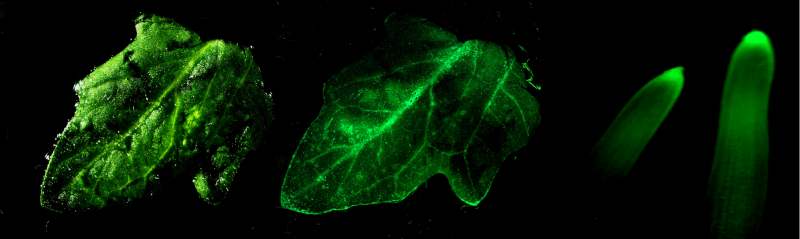
Рис. 6. Детекция экспрессии гена gfp в листьях и корнях трансгенных растений томата: 1) контроль(белый свет) 2) лист (УФ); 3) корень (УФ).
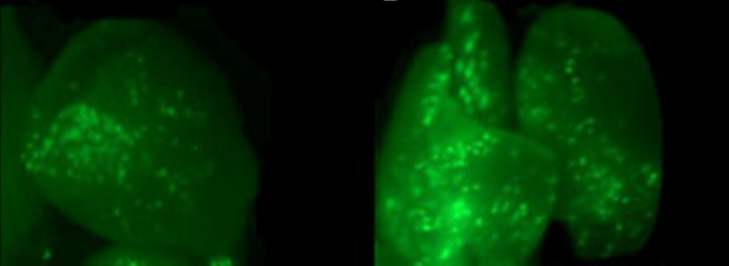
Рис. 7. Транзиентная экспрессия гена gfp в ткани щитка незрелых зародышей ячменя.
Избранные публикации
1. Miroshnichenko D. Assessment of the pollen-mediated transgene flow from the plants of herbicide resistant wheat to conventional wheat (Triticum aestivum L.) / D. Miroshnichenko, A. Pushin, S. Dolgov // Euphytica — 2016. — V. 209. — № 1. — P. 71–84.2. Miroshnichenko D. Somatic embryogenesis and plant regeneration from immature embryos of Triticum timopheevii Zhuk. and Triticumkiharae Dorof. et Migusch, wheat species with G genome / D. Miroshnichenko, M. Chernobrovkina, S. Dolgov // Plant Cell, Tissue and Organ Culture. — 2016. — V. 125. — № 3. — P. 495–508.
3. Alikina О. Tissue culture efficiency of wheat species with different genomic formulas / О. Alikina, M. Chernobrovkina, S. Dolgov, D. Miroshnichenko // Crop Breeding and Applied Biotechnology . — 2016. — V. 16. — № 4. — P. 307–314.
4. Khvatkov, P. Transformation of Wolffia arrhiza (L.) Horkel ex Wimm / P. Khvatkov, M. Chernobrovkina, A.Okuneva, A. Pushin, S. Dolgov // Plant Cell, Tissue and Organ Culture. — 2015. — V. 123. — № 2. — P. 299–307.
5. Khvatkov, P. Callus induction and regeneration in Wolffia arrhiza (L.) Horkel ex Wimm / P. Khvatkov, M. Chernobrovkina, A. Okuneva, A. Shvedova, I. Chaban, S. Dolgov // Plant Cell, Tissue and Organ Culture. — 2015. — V. 120. — № 1. — P. 263–273.
6. Халилуев, M. Р. Зависимость каллусообразования и органогенеза побегов томата (Solanum lycopersicum L.) in vitro от генотипа, типа экспланта и состава питательной среды / M. Р. Халилуев, Л. Р. Богоутдинова, Г. Б. Баранова, Е. Н. Баранова, П. Н. Харченко, С. В. Долгов // Известия РАН. Серия биологическая. — 2014. — № 6. — С. 586–596.
7. Халилуев, М. Р. Аномалии в развитии флоральной меристемы у трансгенных растений томата не зависят от экспрессии генов, кодирующих защитные PR-белки и антимикробные пептиды / М. Р. Халилуев, И. А. Чабан, Н. В. Кононенко, Е. Н. Баранова, С. В. Долгов, П. Н. Харченко, В. Ю. Поляков // Онтогенез. — 2014. — Т. 45. — № 1. — С. 28–41.
8. Мирошниченко, Д. Н. Скрининг регенерационного потенциала ди-, тетра — и гексаплоидных сортов и видов пшеницы в культуре in vitro / Д. Н. Мирошниченко, Р. Н. Соколов, О. В. Аликина, С. В. Долгов // Биотехнология. — 2014. — № 1. — С. 38–51.
9. Тимербаев В.Р. Создание безмаркерных растений томата с геном суперсладкого белка под контролем цис-регуляторных элементов / Тимербаев В.Р., Окунева А.С., Пушин А.С., Долгов С.В. // Тезисы Международной научной конференции по биологии и биотехнологии растений, 28-30 мая 2014 года, г. Алматы, Казахстан. С.423. 10. Титова С.М. Оценка эффективности различных конструкций с геном белка оболочки вируса Б хризантем (CVB) для создания вирусоустойчивых растений / Титова С.М., Митюшкина Т.Ю., Фирсов А.П., Долгов С.В. // Тезисы Международной научной конференции по биологии и биотехнологии растений, 28-30 мая 2014 года, г.Алматы, Казахстан. С.424.
11. Окунева А.С. Получение трансгенных растений томата, экспрессирующих гены транскрипционных факторов петунии EOBI и EOBII / Окунева А.С., Тимербаев В.Р., Долгов С.В. // Тезисы Международной научной конференции по биологии и биотехнологии растений, 28-30 мая 2014 года, г.Алматы, Казахстан. С.453.
12. Хватков П.А. Индукция морфогенеза и агробактериальная трансформация Wolffia arrhiza / Хватков П.А., Шведова А.Н., Чернобровкина М.А., Долгов С.В. // Тезисы Международной научной конференции по биологии и биотехнологии растений, 28-30 мая 2014 года, г.Алматы, Казахстан. С.456.
13. Хватков, П. А. Изучение глубинного культивирования вольфии бескорневой Wolffia arrhiza (L.) Horkel ex Wimm в модифицированном биоректоре / П. А. Хватков, М. А. Чернобровкина, В. В. Синёв, С. В. Долгов // Биотехнология. — 2013. — № 6. — С. 51–56.
14. Митюшкина, Т. Ю. Создание трансгенных растений хризантем, экспрессирующих белок оболочки вируса В / Т. Ю. Митюшкина, А. П. Фирсов, С. В. Долгов // Доклады Российской академии сельскохозяйственных наук. — 2013. — № 4. — С. 17–20.
15. Фирсов, А. П. Трансгенные растения томата — продуценты сверхсладкого белка тауматина II / А. П. Фирсов, А. С. Пушин, И. В. Корнеева, С. В. Долгов // Биотехнология. — 2012. — № 2. — С. 43–49.
16. Мирошниченко, Д. Н. Оптимизация условий для эффективного соматического эмбриогенеза и регенерации растений in vitro яровых сортов мягкой пшеницы / Д. Н. Мирошниченко, М. В. Филиппов, С. В. Долгов // Доклады Российской академии сельскохозяйственных наук. — 2012. — № 6. — С. 22–26.
17. Мирошниченко, Д. Н. Анализ вертикального переноса генов от трансгенных к нетрансгенным растениям пшеницы (Triticum aestivum L.) / Д. Н. Мирошниченко, М. В. Филиппов, С. В. Долгов // Сельскохозяйственная биология. — 2012. — № 3. — С. 37–46.